INTRODUCCIÓN:
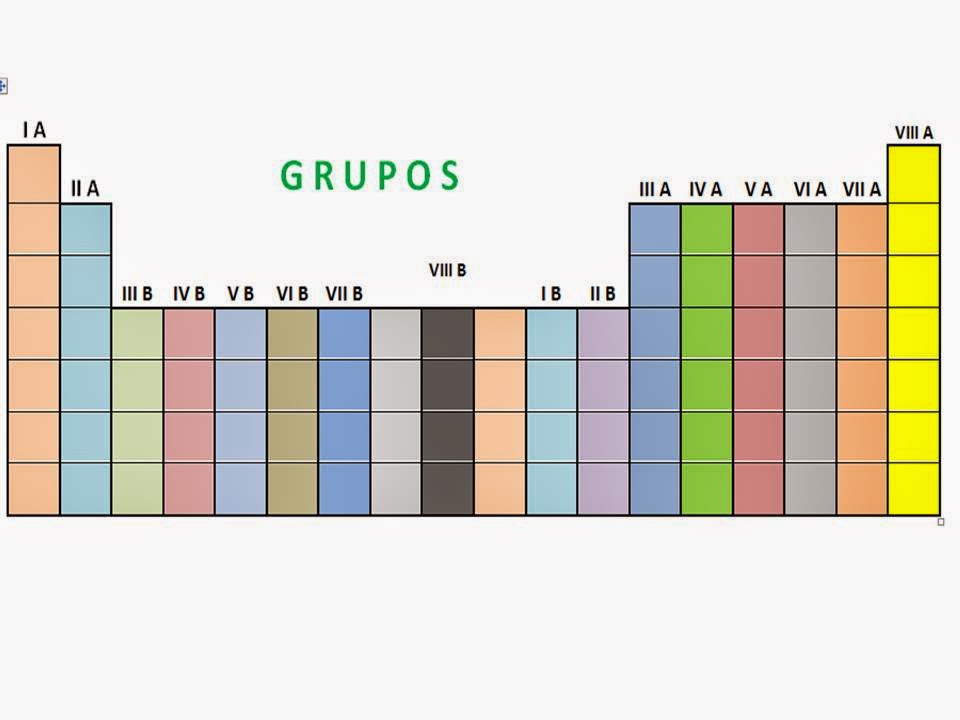
En el trabajo presente, se realizará una consulta
acerca de los grupos de la tabla periódica. Un grupo es una columna de la
tabla periódica de los elementos. Hay 18 grupos en la tabla periódica estándar.
No es coincidencia que muchos de estos grupos correspondan a conocidas familias
de elementos químicos, ya que la tabla periódica se ideó para ordenar estas
familias de una forma coherente y fácil de ver. La explicación moderna del
ordenamiento en la tabla periódica es que los elementos de un grupo tienen
configuraciones electrónicas similares en los niveles de energía más
exteriores; y como la mayoría de las propiedades químicas dependen
profundamente de las interacciones de los electrones que están colocados en los
niveles más externos los elementos de un mismo grupo tienen propiedades físicas
y especialmente químicas parecidas.

OBJETIVOS:
- Obtener conocimientos acerca de los grupos de la tabla periódica.
- Identificar los elementos que pertenecen a los grupos, 4, 5, 6 y 7.
- Aprender aspectos generales y específicos sobre éste tema.
- Tener en cuenta las características que debe tener cada elemento para pertenecer al grupo.
MARCO TEÓRICO
GRUPOS DE LA TABLA PERIÓDICA
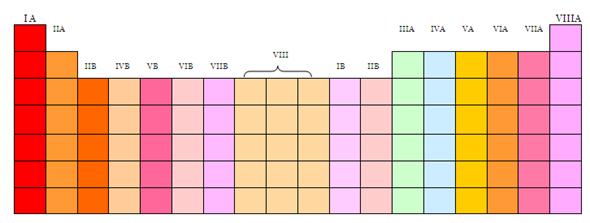
Los grupos se nominan mediante números, que van del 1 al 18. Los elementos que forman cada grupo tienen en general propiedades químicas símiles entre sí, aunque hay excepciones. Esto es debido a que todos coinciden en su configuración electrónica.
Los grupos se clasifican como:
-Los grupos 1 y 2 están compuestos por los elementos metálicos.
-Los grupos del 3 al 12, se encuentran formados por los metales de transición.
-Los grupos del 13 al 17, están constituidos por los elementos no metálicos y los semimetálicos.
-El grupo 18 se constituye por los gases nobles.
Los elementos conocidos como, representativos, forman los grupos de número 1,2 y del 13 al 18. Estos grupos a menudo reciben nombres especiales:
Grupo nº 1: Alcalinos, configuración electrónica, ns^1
Grupo nº 2: Alcalinotérreos, configuración electrónica, ns^2
Grupo nº 16: Calcógenos, configuración electrónica, ns^2 np^4
Grupo nº17: Halógenos, configuración electrónica, ns^2 np^5
Grupo nº18: Gases nobles, configuración electrónica, ns^2 np^6
El resto de los grupos se denominan:
Grupo 3: Familia del Escandio
Grupo 4: Familia del Titanio
Grupo 5: Familia del Vanadio
Grupo 6: Familia del Cromo
Grupo 7: Familia del Manganeso
Grupo 8: Familia del Hierro
Grupo 9: Familia del Cobalto
Grupo 10: Familia del Níquel
Grupo 11: Familia del Cobre
Grupo 12: Familia del Zinc
Grupo 13: Térreos
Grupo 14: Carbonoideos
Grupo 15: Nitrogenoides
Entre los metales de transición se encuentran los elementos conocidos como “tierras raras” o metales de transición interna, grupos que también tienen nombres específicos, lantánidos y actínidos, que generalmente se escriben separados del resto de la tabla, en dos filas de catorce columnas cada uno.
En los elementos de transición, hay un electrón diferenciador que ocupa el orbital d, y los elementos de transición interna poseen un orbital f. Las configuraciones electrónicas de estos grupos de elementos no es rígida y regular como puede serlo en los elementos más representativos, existiendo muchas excepciones.
Los números de electrones que se encuentran en cada subnivel, está directamente relacionado con el número de columnas que hay en la Tabla Periódica, es decir:
-Los grupo de los metales más ligeros son “2”, siendo su orbital de electrón diferenciador “s”, y la capacidad del subnivel es de “2” electrones.
-En el caso de los no metales, semimetales y gases nobles, existen “6” columnas, con un orbital de electrón “p”, y una capacidad de 6 electrones en el subnivel.
-Los metales de transición están divididos en “10” columnas, con un orbital diferenciador “d” y una capacidad de “ 10” electrones.
-Y por último, los metales de transición interna, que están agrupados en 14 columnas, con un orbital “f” y con la capacidad de “14” electrones en su subnivel.
Vemos así, que coincide el número de electrones que entran en un subnivel, con la cantidad de columnas.
GRUPO IVA : Familia del Carbono
Tabla periódica
El grupo 14 de la tabla periódica es también llamado como la familia del carbono o los carbonoideos.
El grupo 14 está formado por los siguientes elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) y flerovio (Fl).

Estos elementos componen más del 28% en masa de la corteza, siendo el silicio el más abundante, luego seguido del carbono. El germanio es el elemento menos abundante.
El silicio es el elemento principal de toda la estructura inorgánica y el carbono es el responsable de la vida orgánica de la superficie terrestre.
Los elementos metálicos de este grupo están clasificados en la tabla periódica como “otros metales” junto a los grupos 13 y 15. Poseen cuatro electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np2 (2 electrones s y 2 electrones p), exhibiendo los siguientes estados de oxidación: +4, +2 y -4: los compuestos con +4 y la mayoría de los de número de oxidación +2 son covalentes. El único ion -4 es el carburo.
Propiedades físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
Por ejemplo, el primer elemento del grupo, el carbono es un no metal duro y sólido a temperatura ambiente. Este elemento puede encontrarse en la naturaleza en forma de carbono amorfo (grafito) y en forma de diamante. Ambas formas alotrópicas poseen coloraciones distintas, siendo el grafito de color negro y el diamante incoloro.
Los elementos silicio y germanio, son los metaloides del grupo, y presentan una dureza intermedia. El silicio posee propiedades intermedias entre el carbono y el germanio. Su forma cristalina es bastante dura y muestra un brillo metálico de color grisáceo.
El metaloide germanio es de color blanco grisáceo lustroso, quebradizo y conserva el brillo a temperaturas normales. Este elemento exhibe la misma estructura cristalina que el diamante.
Los metales de este grupo son el estaño y el plomo. El estaño es de color plateado y maleable. Por su parte, el plomo es un metal pesado que rara vez se encuentra en estado elemental. Es de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, inelástico y se funde con facilidad.
Los puntos de fusión y ebullición son menores a medida de que se desciende en el grupo. Esto debido a que se pierde la fuerza de enlace entre los átomos.
Propiedades químicas:
Los elementos del grupo 14 poseen algunas propiedades químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo. La concatenación se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica.

Propiedades generales:
- El Carbono es un no metal.
- El Silicio y el Germanio son semimetales, conducen la corriente eléctrica cuando aumentan de temperatura.
- El Estaño y el Plomo son metales. Son semiconductores.
- El Estaño y el Plomo se utilizan para preparar aleaciones de bajos puntos de fusión.
Elementos:
Carbono C:
- Símbolo: C
- Masa atómica: 12,0107 u
- Configuración electrónica: [He] 2s22p2
- Punto de fusión: Diamante: 3823 K; Grafito: 3800 K
- Densidad: 2267 kg/m3´
El carbono es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados.
El carbono presenta dos formas alotrópicas el carbono amorfo que es el grafito y el carbono cristalino que es el diamante. Ambos presentan usos bastantes importantes.
También, presenta múltiples aplicaciones siendo la más importante como componente de hidrocarburos, principalmente los combustibles fósiles, es decir, petróleo y gas natural.
Silicio:
- Símbolo: Si
- Configuración electrónica: [Ne] 3s23p2
- Número atómico: 14
- Masa atómica: 28,0855 u
- Densidad: 2330 kg/m3
- Grupo, período, bloque: 14, 3, p

El silicio es un semimetal y por lo tanto un semiconductor. Este elemento puede controlar el flujo eléctrico mediante el uso de partes de silicio; lo que lo hace indispensable en la industria eléctrica. Se utiliza en los ordenadores, radios, células solares, pantallas LCD y otros aparatos semiconductores.
De los compuestos importantes del silicio está el óxido de silicio (IV) o dióxido de silicio (SiO2) o como se le conoce también sílice. Este compuesto se puede encontrar en la arena. La sílice se emplea para elaborar vidrio artificial, cerámicas, ladrillos, cemento, entre otros. El gel de sílice es un desecante, es decir que absorbe la humedad del lugar en que se halla.
Las siliconas son materiales que se encuentran dentro del grupo de los polímeros y es un derivado del silicio. Poseen un sin número de aplicaciones como por ejemplo: como selladores en la fabricación de acuarios, en la industria automotriz como lubricante para los frenos, como recubrimiento en telas, en el campo de la medicina para la elaboración de implantes quirúrgicos, en utensilios de cocina, juguetes y como componente activo en los antiespumas.
Germanio:
- Símbolo: Ge
- Configuración electrónica: [Ar] 3d104s24p2
- Densidad: 5323 kg/m3
- Electrones por nivel: 2, 8, 18, 4 (imagen)
- Grupo, período, bloque: 14, 4, p
- Nombre, símbolo, número: Germanio, Ge, 32

El germanio al igual que el silicio es un semiconductor ampliamente utilizado en la industria electrónica. También se emplea en aleaciones con galio y arsénico para elaborar transistores y todo tipo de aparatos tecnológicos.
Estaño:
- Símbolo: Sn
- Punto de fusión: 231,9 °C
- Configuración electrónica: [Kr] 4d105s25p2
- Masa atómica: 118,71 u
- Número atómico: 50
- Densidad: 7365 kg/m3

El estaño es usado abundantemente en aleaciones con otros elementos como por ejemplo, con el cobre para obtener bronce, con el plomo en la soldadura, con el titanio para la industria aeroespacial. Por su parte, la aleación estaño-plomo-antimonio se usa para producir el metal de imprenta. Aleado con el niobio es usado en semiconductores y en el galvanizado de hilos conductores.
Este elemento también es usado, de igual manera, como capa protectora en el revestimiento de latas de hierro y cobre. Se emplea para disminuir la fragilidad del vidrio.Algunos compuestos de estaño también se usan en fungicidas, tintes, pastas dentales y tintes.
Plomo:
- Símbolo: Pb
- Masa atómica: 207,2 u
- Configuración electrónica: [Xe] 4f145d106s26p2
- Número atómico: 82
- Punto de fusión: 327,5 °C
- Densidad: 11340 kg/m3

El plomo posee una gran cantidad de aplicaciones siendo la más destacada en la elaboración de baterías. También se emplea en aleaciones, como por ejemplo con estaño para usarse en soldadura, revestimiento y utensilios de radiaciones. Aleado con arsénico para la insonorización de edificaciones, elaboración de perdigones, entre otros.
Algunos de los compuestos de plomo se utilizan en la industria del vidrio como aditivo y pigmento, en la industria electrónica para tubos de televisión, en la industria del plástico como estabilizante, entre otros. Algunos labiales contienen plomo. De igual manera, se utilizan como antidetonantes en la gasolina y en pinturas y barnices pero actualmente se han ido reemplazando su uso por la toxicidad del mismo.
Flerovio:
- Símbolo: Fl
- Densidad: 14 (predicción) kg/m3
- Configuración electrónica: 5f14 6d10 7s2 7p2; (predicción)
- Punto de fusión: 340 K (67 °C) (predicción)
- Punto de ebullición: 420 K (147 °C) (predicción)

Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.
GRUPO VA : Familia del Nitrógeno
Tabla periódica
El grupo 15 está formado por los siguientes elementos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovium (Mc). Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
Propiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.

De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.

Nitrógeno:
- Símbolo: N
- Masa atómica: 14,0067 u
- Densidad: 1,2506 kg/m3
- Nombre, símbolo, número: Nitrógeno, N, 7
- Estado(s) de oxidación: ±3, 5, 4, 2, 1 (ácido fuerte)
- Estado ordinario: Gas

El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión. El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Fósforo:
- Símbolo: P
- Masa atómica: 30,973762 u
- Configuración electrónica: 1s22s22p63s23p3
- Número atómico: 15
- Electronegatividad: 2,19
- Descubridor: Hennig Brand

Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
Arsénico As
- Símbolo: As
- Configuración electrónica: [Ar] 3d104s24p3
- Número atómico: 33
- Masa atómica: 74,9216 u
- Electrones por nivel: 2, 8, 18, 5 (imagen)
- Densidad: 5727 kg/m3

El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.
Antimonio:
- Símbolo: Sb
- Configuración electrónica: [Kr] 4d105s25p3
- Número atómico: 51
- Electrones por nivel: 2, 8, 18, 18, 5 (imagen)
- Densidad: 6697 kg/m3
- Grupo, período, bloque: 15, 5, p
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.
Bismuto:
- Símbolo: Bi
- Número atómico: 83
- Configuración electrónica: [Xe] 4f145d106s26p3
- Masa atómica: 208,9804 u
- Densidad: 9780 kg/m3
- Electrones por nivel: 2, 8, 18, 32, 18, 5

Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.
GRUPO NÚMERO 4B
Tabla periódica
La familia del titanio O GRUPO 4 pertenece a los metales de transición y está conformado por los elementos: titanio (Ti), circonio (Zr) y hafnio (Hf) y rutherfordio (Rf).
Este grupo al presentar 2 electrones s de la última capa y 2 d de la penúltima capa, es decir, 4 electrones de valencia; muestran propiedades similares a las del grupo 3, exceptuando el número de oxidación que es +4. Otros estados de oxidación que presentan estos elementos son +3 y +2, sin embargo la estabilidad de los compuestos con estos estados de oxidación disminuye al bajar en el grupo.
Propiedades físicas:
• Son sólidos a temperatura ambiente
• Son de color plateado y poseen brillo metálico
• Conducen calor y electricidad
• Presentan altos puntos de fusión y de ebullición

Propiedades químicas:
• Predomina el estado de oxidación +4.
• Son bastante reactivos. La reactividad aumenta a medida que se desciende en el grupo.
• Forman compuestos de coordinación, esto debido a su facilidad para formar enlaces covalentes con la participación de electrones d y por su tendencia a reaccionar químicamente en diferentes estado de oxidación estables y a cambiar con relativa facilidad de unos estados de oxidación a otros.
Elementos:
- Titanio:
- Es un metal de transición
- Número atómico Z=22
- Color plateado
El titanio es utilizado principalmente en aleaciones para la fabricación de aviones, helicópteros, blindaje, buques de guerra, naves espaciales y misiles. Esto debido a que estas aleaciones son bastante fuertes y resistentes a la corrosión.
El compuesto más abundante de titanio es el dióxido de titanio, el cual podemos encontrar en la pasta dental, pintura, papel y en algunos plásticos. De igual manera, el cemento y las piedras preciosas contienen óxido de titanio.

Es común el uso de dióxido de titanio para fabricar cañas de pescar y palos golf proporcionándoles dureza y resistencia.
- Circonio:
- Es un metal de transición
- Número atómico Z=40
- Color blanco grisáceo

La principal utilidad que presenta el circonio es en la obtención de energía nuclear. El 90% del circonio que se emplea en las actividades humanas se usa en el recubrimiento de reactores nucleares.
El óxido impuro de circonio se utiliza en la elaboración de equipos de laboratorio, hornos metalúrgicos y materiales refractarios en vidrio. También se usa en la fabricación de tubos de vacío, aparatos quirúrgicos, en aleaciones y como aditivo.
- Hafnio:
- Es un metal de transición
- Número atómico Z=72
- Color gris plateado

Este elemento se emplea en la elaboración de filamentos eléctricos en aleación con wolframio y tántalo.
También se emplea, junto al circonio como material estructural en las plantas nucleares de energía, debido a su alta resistencia a altas temperaturas.
- Rutherfordio:
- Es un metal de transición
- Número atómico Z=104
- Es un elemento artificial de aspecto desconocido radioactivo
El rutherfordio es un elemento químico artificial de origen sintético y que se identifica por su alta radiactividad, conociéndose muy poco sobre sus propiedades. Por tal razón, no posee utilidad comercial. Su uso más común es en la investigación científica.
GRUPO NÚMERO 5B
Tabla periódica
La familia del vanadio pertenece a los metales de transición y está conformado por los elementos: vanadio (V), niobio (Nb), tantalio (Ta) y dubnio (Db).
Este grupo posee en sus niveles electrónicos más externos cinco electrones de valencia, es decir, 2 electrones s de la última capa y 3 electrones d en la penúltima.
La estabilidad del estado de oxidación +5, el cual es el predominante en el grupo, va en aumento a medida que también aumenta el número atómico en combinaciones del tipo ácido.

Propiedades físicas:
- Son sólidos a temperatura ambiente
- Son de color plateado y poseen brillo metálico
- Conducen calor y electricidad
- Presentan altos puntos de fusión y de ebullición
Propiedades químicas:
- Predomina el estado de oxidación +4.
- Son bastante reactivos. La reactividad de estos elementos aumenta a medida que se desciende en el grupo.
- Son poco nobles, aunque al estar recubiertos por una capa superficial de óxido provoca una inercia química que es superada a altas temperaturas.
- Sólo producen complejos solubles con ácido fluorhídrico (HF).
- La fusión de sus óxidos con hidróxidos alcalinos origina vanadatos, niobatos y tantalatos.
- Forman compuestos de coordinación, esto debido a su facilidad para formar enlaces covalentes con la participación de electrones d y por su tendencia a reaccionar químicamente en diferentes estado de oxidación estables y a cambiar con relativa facilidad de unos estados de oxidación a otros.
Elementos:
- Vanadio:
- Es un metal de transición
- Número atómico Z=23
- Color gris metálico plateado
El principal uso de este metal de transición es en aleaciones como las de Vanadio-Níquel y Vanadio-Cromo, esto debido a que proporciona dureza y resistencia a la tensión. El acero originado por al aleación Vanadio-Cromo es ideal para la construcción de muelles, engranajes de transmisión y otras piezas de motores. Por su parte, el acero que surge de la aleación Vanadio-Titanio, es utilizado en los cascos de cohetes, alojamientos de los motores de aviones reactores y para los componentes de los reactores nucleares.
- Niobio:
- Es un metal de transición
- Número atómico Z=41
- Color metálico grisáceo

El niobio es usado ampliamente en la aleación con el acero inoxidable, debido a que suministra mayor resistencia a la corrosión, especialmente a altas temperaturas.
El niobio en estado puro posee propiedades adecuados para ser usado como material de construcción para plantas de energía nuclear.
- Tantalio:
- Es un metal de transición
- Número atómico Z=73
- Color gris azulado

El tantalio al igual que los otros elementos que conforman este grupo, es usado principalmente en aleaciones ya que posee una gran resistencia a la corrosión, una gran ductilidad y un alto punto de fusión.
Este metal se emplea como filamento para evaporar metales como el aluminio; y en la elaboración de condensadores electrolíticos y piezas del horno de vacío.
El tantalio es usado como pieza de los equipamientos electrónicos de uso cotidiano como: teléfonos móviles, cámaras, relojes finos, entre otros.
- Dubnio:
- Es un metal de transición
- Número atómico Z=105
- Es un elemento artificial de aspecto desconocido radioactivo

Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no poseen uso comercial. Por lo tanto, es empleado en la investigación científica.
GRUPO NÚMERO 6B
Tabla periódica
El grupo seis de la tabla periódica también es denominado como la familia del cromo, ya que los elementos que lo conforman poseen comportamientos representativos del elemento principal. En este caso es el cromo.
El grupo 6 está conformado por: Cromo (Cr), Molibdeno (Mo), Wolframio o Tungsteno (W) y Seaborgio (Sg).

Estos metales de transición presentan 6 electrones de valencia: 2 electrones s de la última capa y 4 electrones d de la penúltima. El estado de oxidación máximo que pueden alcanzar es el +6 y la estabilidad de este estado aumentan con el número atómico y decrece (a números de oxidación más pequeños, a medida que decrece el número atómico.
Al igual que con los grupos que estudiamos anteriormente, la similitud entre el molibdeno y wolframio es mayor que con el elemento principal (cromo).
Propiedades Físicas:
- Son de color plateado y poseen brillo metálico
- Son sólidos a temperatura ambiente
- Conducen calor y electricidad
- Presentan altos puntos de fusión y de ebullición
Propiedades química:
- Predomina el estado de oxidación +6
- Son muy resistentes a la corrosión.
- Son bastante reactivos. La reactividad aumenta a medida que se desciende en el grupo.
- Forman compuestos de coordinación, esto debido a su facilidad para formar enlaces covalentes con la participación de electrones d y por su tendencia a reaccionar químicamente en diferentes estado de oxidación estables y a cambiar con relativa facilidad de unos estados de oxidación a otros.
Elementos:
- Cromo:
- Es un metal de transición
- Número atómico Z=24
- Color gris metálico plateado

El cromo es usado primordialmente en aleaciones con otros metales como hierro, níquel o cobalto, ya que permite elevar la dureza, tenacidad y resistencia a la corrosión. Un ejemplo de este tipo de aleaciones es la del acero inoxidable, donde el cromo constituye el 10% o más de la composición final.
El cromo ha sido usado desde hace mucho tiempo en la industria automovilística ya que suministra un acabado brillante, duro y resistente. No obstante ya ha sido suplantado por los plásticos.
- Molibdeno:
- Es un metal de transición
- Número atómico Z=42
- Color metálico grisáceo

Este metal de transición es utilizado principalmente en aleaciones, entre la que destacan los aceros más duros y resistentes. Para la elaboración de acero inoxidable es usado una proporción de aproximadamente 6% de molibdeno. Esta aleación es muy buena ya que soporta altas temperaturas y presiones siendo muy resistente, por lo que se emplea en la construcción, en la elaboración de piezas de aviones y coches.
- Wolframio:
- Es un metal de transición
- Número atómico Z=74
- Color grisáceo metálico

El wolframio al igual que los metales anteriores, es usado principalmente en aleaciones para la elaboración de filamentos, lámparas eléctricas, tubos para televisión y dispositivos electrónicos todo tipo.
- Seaborgio:
- Es un metal de transición
- Número atómico Z=106
- Es un elemento artificial de aspecto desconocido radioactivo

Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no poseen uso comercial. Por lo tanto, es empleado en la investigación científica.
GRUPO NÚMERO 7B
Tabla periódica
El grupo 7 de la tabla periódica pertenece a los metales de transición y es nombrado también como la familia del manganeso, ya que los elementos que lo conforman poseen comportamientos representativos del elemento principal. En este caso es el manganeso.
El grupo 7 está conformado por: Manganeso (Mn), Tecnecio (Tc), Renio (Re) y Bohrio (Bh).

Estos metales presentan 7 electrones de valencia: 2 electrones s de la última capa y 5 electrones d de la penúltima. El estado de oxidación máximo que pueden alcanzar es el +7 y la estabilidad de este estado aumenta con el número atómico y decrece (a números de oxidación más pequeños, a medida que decrece el número atómico.
Aunque en menor medida, al igual que con los grupos que estudiamos anteriormente, la similitud entre el tecnecio y renio es mayor que con el elemento principal (manganeso).
Propiedades físicas
- Son de color plateado y poseen brillo metálico
- Son sólidos a temperatura ambiente
- Conducen calor y electricidad
- Presentan altos puntos de fusión y de ebullición
Propiedades químicas:
- Predomina el estado de oxidación +7
- El tecnecio y le renio no poseen isotopos estables.
- Son atacados lentamente por el oxígeno a temperatura ambiente, pero rápidamente a temperaturas elevadas.
- Son bastante reactivos. La reactividad aumenta a medida que se desciende en el grupo.
- Forman compuestos de coordinación, esto debido a su facilidad para formar enlaces covalentes con la participación de electrones d y por su tendencia a reaccionar químicamente en diferentes estado de oxidación estables y a cambiar con relativa facilidad de unos estados de oxidación a otros.
Elementos:
- Manganeso:
- Es un metal de transición
- Número atómico Z=25
- Color gris metálico plateado

El manganeso es utilizado ampliamente en aleación con el hierro originando una aleación llamada ferromanganeso, que posee una gran dureza y se usa para elaborar aceros especiales. Por ejemplo, las cajas fuertes las realizan con este acero que tiene aproximadamente un 12% de manganeso.
- Tecnecio:
- Es un metal de transición
- Número atómico Z=43
- Color metálico plateado
- Presenta radioactividad
Este elemento se emplea principalmente como inhibidor de la corrosión para el acero. De igual manera, es muy eficaz como súper- conductor.
En la medicina nuclear y la química es usado el tecnecio en las técnicas escintigráficas como trazador por su corto período y su habilidad para fijarse en los tejidos.
- Renio:
- Es un metal de transición
- Número atómico Z=75
- Color blanco grisáceo

El renio es un elemento bastante resistente a la corrosión, por lo cual es usado ampliamente como material de contacto eléctrico.
Otro uso importante es en la aleación Renio-Wolframio, para la elaboración de termopares, varillas de soldadura, imanes criogénicos, filamentos eléctricos y de flashes fotográficos. Se emplea, también como aditivo metálico y catalizador.
- Bohrio:
- Es un metal de transición
- Número atómico Z=107
- Es un elemento artificial de aspecto desconocido radioactivo
El bohrio no posee uso comercial y tampoco es utilizado por los científicos para sus investigaciones.
CONCLUSIONES
- A las columnas verticales de la tabla periódica se les conoce como grupos.
- Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos
- Todos los elementos de cada grupo observado son metales en transición.
- Los elementos vistos tienen comportamientos y utilidades similares en la vida cotidiana.






JUEGO 5,0
ResponderBorrarEL TRABAJO ERA DE LOS GRUPOS 4,5,6,7 A NO DE TRANSACCIÓN 3,5
DEFINITIVA 4,2