REACCIONES QUÍMICAS

INTRODUCCIÓN
En el trabajo presente, se realizará una consulta acerca de la reacción química, también llamada cambio químico o
fenómeno químico, que es todo proceso termodinámico en el cual dos o más sustancias
(llamadas reactantes o reactivos), se transforman, cambiando su estructura
molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes
pueden ser elementos o compuestos. Un ejemplo de reacción química es la
formación de óxido de hierro producida al reaccionar el oxígeno del aire con el
hierro de forma natural, o una cinta de magnesio al colocarla en una llama se
convierte en óxido de magnesio, como un ejemplo de reacción inducida.
OBJETIVOS:
- Obtener conocimientos acerca de las reacciones químicas.
- Identificar como formular una ecuación química.
- Aprender aspectos generales y específicos sobre éste tema.
- Tener en cuenta los pasos propuestos para escribir una ecuación química.
REACCIÓN QUÍMICA
La reacción química es la forma en que una sustancia
reacciona frente a otra. En una reacción química existen las sustancias que
reaccionan, o sea las reactantes, y las sustancias producidas, llamadas
productos.
Las reacciones químicas forman parte de las propiedades
químicas e indican su comportamiento frente a otras mezclas y sustancias en la
formación de nuevos productos.

En una reacción química se desencadena el proceso de ruptura
de enlaces químicos creando espontáneamente, o por manipulación, una nueva
ecuación o sustancia química. Por lo tanto, en una reacción química se deben
juntar, mezclar o manipular las sustancias reactantes para la creación de
productos químicos.
Dentro del área de la química orgánica que estudia las
estructuras basadas en moléculas de carbono, en la fotosíntesis de las plantas,
por ejemplo, existe una reacción química que transforma el dióxido de carbono
absorbido por la clorofila de las hojas de las plantas en oxígeno.
A la representación simbólica de cada una de las reacciones
se le denomina ecuación química.
Los productos obtenidos a partir de ciertos tipos de
reactivos dependen de las condiciones bajo las que se da la reacción química.
No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos
pueden variar según cambien las condiciones, determinadas cantidades permanecen
constantes en cualquier reacción química. Estas cantidades constantes, las
magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la
carga eléctrica y la masa total.

CARACTERÍSTICAS O EVIDENCIAS:
- Formación de precipitados.
- Formación de gases acompañados de cambios de temperatura. Desprendimiento de luz y de energía.
REGLAS:
Ej. :
- En toda reacción se conservan los átomos y las cargas (si hay iones)
- No puede ocurrir un proceso de oxidación o de reducción aislado, ambos ocurren simultáneamente.
- No se pueden formar productos que reaccionen enérgicamente con alguno de los productos obtenidos.
SIMBOLOGÍA
- Flecha hacia la derecha ( --->): Esta indica una reacción directa
- Flecha hacia la izquierda ( <--- ): Especifica una reacción inversa
- Flechas reversibles: Expresa una reacción reversible
- Triángulo: Indica calor
- Flecha hacia arriba: Expresa la formación de un gas
- Flecha hacia abajo: Formación de un sólido que se encuentra en estado de precipitación
- CC: Expresa la necesidad de corriente continua para realizar la reacción
- 200°-400°: Expresa la temperatura que se necesita para que se realice la reacción
- Letras ( g, s, l, ac): Indica el estado en que se encuentran las sustancias de la reacción.

ECUACIÓN QUÍMICA
Una ecuación química es una descripción simbólica de una
reacción química. Muestra las sustancias que reaccionan (llamadas reactivos) y
las sustancias que se originan (llamadas productos). La ecuación química ayuda
a visualizar los reactivos que son los que tendrán una reacción química y los
productos, que son las sustancias que se obtienen de este proceso. Además, se
pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos
que estén dentro de la ecuación y poder balancearlos con mayor facilidad.

Para poder representar lo que ocurre en una reacción química
mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la
materia y con la Ley de conservación de la energía. Es decir, la ecuación debe
indicar que el número de átomos de los reactivos y productos es igual en ambos
lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se
debe contar con una ecuación balanceada.
Por ejemplo, si ponemos en contacto gas oxígeno y gas
hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En
este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay
inicialmente y que van a "desaparecer" decimos que son las sustancias
que reaccionan o los reactivos y el agua que es la nueva sustancia, la que
"aparece", decimos que es el producto.
H2
(g) +
O2 (g) e H2O (l)
SIGNIFICADO DE LAS ECUACIONES QUÍMICAS:

a) Cualitativo: Indica la clase o calidad de las sustancias reaccionantes y productos. En la ecuación anterior, el magnesio reacciona con el oxígeno para obtener óxido de magnesio
b) Cuantitativo: Representa la cantidad de átomos, moléculas, el peso o el volumen de los reactivos y de los productos.
En la ecuación química anterior, se entiende que dos moléculas (o moles) de magnesio, reaccionan con una molécula ( o mole) de oxígeno para obtenerse dos moléculas ( o moles) de óxido de magnesio. También se puede calcular la cantidad en gramos del producto, tomando como base los pesos atómicos de los reaccionantes (Con ayuda de la Tabla Periódica) .
CARACTERÍSTICAS DE LAS ECUACIONES QUÍMICAS:
- Los reactantes y productos se representan utilizando símbolos para los elementos y fórmulas para los compuestos.
- Se debe indicar el estado físico de los reactantes y productos entre paréntesis: (g), (l), (s), (ac.) si se presentan en estado gaseoso, líquido, sólido o en solución acuosa respectivamente.
- El número y tipo de átomos en ambos miembros deben ser iguales, conforme al principio de conservación de la masa; si esto es así, la ecuación está balanceada.
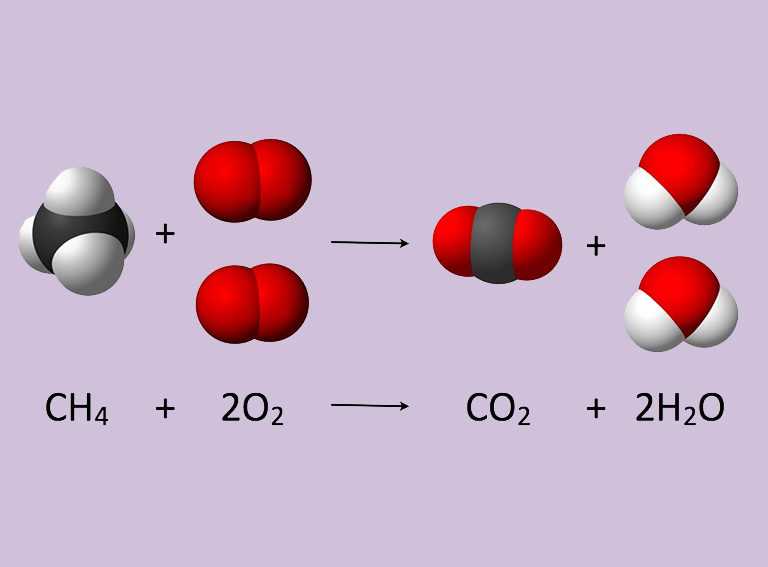
¿CÓMO ESCRIBIR UNA ECUACIÓN QUÍMICA?
1 1.) Se determina cuales son los reactivos y los productos.

2.) Se escribe una ecuación no ajustada usando las fórmulas
de los reactivos y de los productos.
3.) Se ajusta la reacción determinando los coeficientes que
nos dan números iguales de cada tipo de átomo en cada lado de la flecha de
reacción, generalmente números enteros.
EJEMPLO:
Paso 1:
- Sabemos que en esta reacción se consume (O2) y
produce agua (H2O) y dióxido de carbono (CO2).
Luego:
Los reactivos son CH4 y O2
Los productos son H2O y CO2
Paso 2:
-
La ecuación química sin ajustar será:
Paso 3:
-
Ahora contamos los átomos de cada reactivo y de
cada producto y los sumamos:
Entonces,
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
una molécula de metano reacciona con dos moléculas de oxígeno para producir dos moléculas agua y una molécula de dióxido de carbono.
CLASES DE REACCIONES QUÍMICAS
REACCIÓN DE COMPOSICIÓN O SÍNTESIS:
En las
reacciones de síntesis o composición es donde dos reactantes se combinan para
formar un solo producto. Muchos elementos reaccionan con otro de esta manera
para formar compuestos, por ejemplo:
2CaO(s) + 2H2O(l) → 2Ca(OH)2(ac)
En esta fórmula
se mezclan 2 moles de óxido de calcio sólido
con 2 moles de agua líquida reacciona produciendo 2 moles de dihidróxido de
calcio acuoso.
REACCIÓN DE DESCOMPOSICIÓN O ANÁLISIS:
Este tipo de
reacción es contraria a la de composición o síntesis ya que en esta no se unen
2 o más moléculas para formar una sola, sino que una sola molécula se divide o
se rompe para formar varias moléculas mas sencillas, por ejemplo:
2HgO (s) → 2Hg(l) + O2(g)
En esta fórmula
una 2 molécula de óxido de mercurio sólido se descomponen o dividen para formar
2 moléculas de mercurio y una de oxígeno, las cuales son más sencillas que la
primera.
REACCIÓN DE DESPLAZAMIENTO O SUSTITUCIÓN:
En este tipo de
reacción, un elemento libre sustituye y libera a otro elemento presente en un
compuesto, su ecuación general es:
CuSO4 + Fe → FeSO4 + Cu
En esta
reacción una mol de sulfato de cobre con 1 mol de hierro para formar sulfato de
hierro y cobre.
REACCION DE DOBLE SUSTITUCIÓN O DOBLE
DESPLAZAMIENTO:
Son
aquellas reacciones que se dan por intercambio de átomos entre los reactivos
AB +
CD--------------- AC + BD
Por Ejemplo:
K2S + MgSO4 → K2SO4 + MgS
En esta
reacción 1 mol de sulfuro de potasio reaccionan con sulfato de magnesio para
formar sulfato de potasio y sulfuro de magnesio.
Es difícil
encontrar reacciones inorgánicas comunes que puedan clasificarse correctamente
como de doble sustitución.
WEBGRAFÍA
- https://definicion.de/reaccion-quimica/
- https://laquimicablog09.wordpress.com/2014/11/17/caracteristicas-de-las-reacciones-y-ecuaciones-quimicas/
- https://laquimicablog09.wordpress.com/2014/11/17/caracteristicas-de-las-reacciones-y-ecuaciones-quimicas/

No hay comentarios.:
Publicar un comentario