NEUTRALIZACIÓN
Introducción:
En el siguiente blogg se establecerán una serie de pantallazos acerca de la neutralización, que es la reacción que existe entre un ácido y una base, dichos pantallazos fueron tomados en el software educativo, Yenka.
Objetivos:
- Conocer acerca de la neutralizacón.
- Tener conocimientos en nomenclatura.
- Obtención de el agua y las sales.
MARCO TEÓRICO
Neutralización;
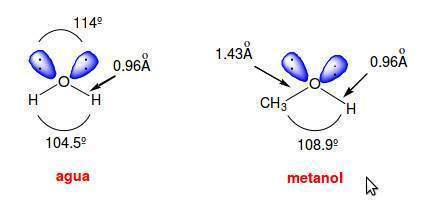
La reacción entre un ácido y una base se llama neutralización. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Si una de las especies es de naturaleza débil y la neutralización se produce en disolución acuosa también se obtiene su respectiva especie conjugada y agua. Se puede decir que la neutralización es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal.
La ecuación general que representa este tipo de reacción es:
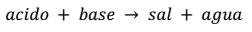
Por ejemplo, la reacción de neutralización que se produce entre el ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
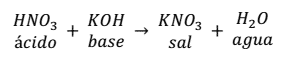
Como se puede observar en la reacción, la sal se forma entre el anión () del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido sulfúrico y el hidróxido de sodio.
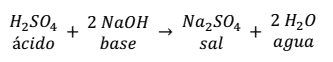
Como se puede observar en la reacción, la sal se forma entre el anión () del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre ácidos fuertes y bases fuertes, es siempre la misma.
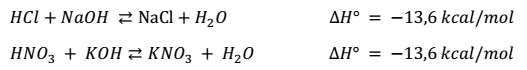
Pantallazos:
Vasos trabajados:
1.
Hidróxido de potasio + Ácido nìtrico = Agua -Nitrato de potasio
KOH + HNO3 → H2O + KNO3
2.
Ácido clorhídrico + hidróxido de sodio = Agua +Cloruro de Sodio
HCl + NaOH ---> H2O + NaCl
3.
Hidróxido de sodio + Ácido sulfùrico = Agua + Sulfato de sodio
4.
Ácido nìtrico + hidróxido de sodio = Agua + Nitrato de sodio
HNO3 + NaOH ---> H2O + NaNO3
PH
Introducción:
En la presente sección del laboratorio, se realizará un análisis sobre el Ph, también utilizando el software educativo de Yenka, que nos aclaraá el tema mencionado, con una serie de pantallazos para un aprendizaje significativo. El ph es una unidad de medida que sirve para establecer el nivel de acidez o alcalinidad de una sustancia.
Objetivos:
- Conocer los distintos indicadores de ph.
- Obtener nuevos conocimientos acerca del ph y su escala.
- Definir conceptos que no han sido empleados anteriormente.
MARCO TEÓRICO
PH:
El pH es una medida de acidez o alcalinidad de una disolución. El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones.2 La sigla significa potencial de hidrógeno o potencial de hidrogeniones. El significado exacto de la p en «pH» no está claro, pero, de acuerdo con la Fundación Carlsberg, significa «poder de hidrógeno».3 Otra explicación es que la p representa los términos latinos pondus hydrogenii («cantidad de hidrógeno») o potentia hydrogenii («capacidad de hidrógeno»). También se sugiere que Sørensen usó las letras p y q (letras comúnmente emparejadas en matemáticas) simplemente para etiquetar la solución de prueba (p) y la solución de referencia (q).4 Actualmente en química, la p significa «cologaritmo decimal de» y también se usa en el término pKa, que se usa para las constantes de disociación ácida.5
Este término fue acuñado por el bioquímico danés S. P. L. Sørensen (1868-1939), quien lo definió en 1909 como el opuesto del logaritmo de base 10 o el logaritmo negativo de la actividad de los iones hidrógeno. Esto es:


¿Qué significa el nivel de ácido en el pH?
Cuando se obtiene mediante una medida de pH que un producto, sustancia o elemento es ácido, quiere decir que posee una alta o baja cantidad de iones de hidrógeno (dependiendo del nivel).
Por su parte, que la medición arroje que una sustancia es alcalina (base), significa que no cuenta con estas concentraciones de iones de hidrógeno. Por lo tanto el pH no es más que el indicador del potencial de hidrógenos.
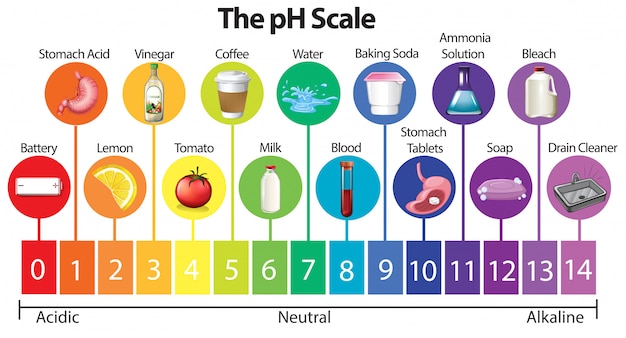
Escala del PH:
Así como para establecer los metros de una tabla, se usa una cinta de medir que posee milímetros, centímetros y metros, igualmente el pH cuenta con su propia escala. De esta forma encontraremos que ésta va desde 0 a 14.
Alcanzar el 0 (cero) es indicador de máxima acidez, por su parte, 14 es el opuesto, base. El punto intermedio es el 7, como su nombre indica, es lo neutral.

Fenoftaleína:
Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol, anhídrido ftálmico y ácido sulfúrico (H2SO4); sus cristales son incoloros.

Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico.
Indicador universal:
Un indicador de pH es una sustancia que sirve para medir el pH de un medio. Se ultiliza para saber si la sustancia examinada es ácida o base.

Existen 14 tipos de pH diferentes, aunque en la imagen de la izquierda solo se distingan 12. El pH número 7 es el color que adopta una sustancia cuando es neutra. Si la sustancia es ácida la sustancia adoptara alguno de los colores entre el pH 1 y el pH 6. Los colores de esa franja dependerán de la concentración de el ácido y de lo fuerte o débil que sea. Al contrario, si la sustancia analizada sería base, el color que adoptaría estaría entre el pH 8 y el pH 14.
Tornasol:
El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos acidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece solo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleina.
El tornasol se suministra comúnmente en forma de una solución (llamada titunta) muy concentrada. En raras ocasiones se utiliza puro, en forma de polvo violeta altamente colorante o en tiras indicadoras. Debido a la poca diferencia de color entre el tornasol neutro y el tornasol en contacto con una base, puede encontrarse con un añadido de un 1% de ácido clorhídrico o sulfúrico diluidos. En tal caso, su color es rojo y oscurece inmediatamente a violeta con un líquido básico.

Pantallazos:
Fenolftaleína
Indicador universal
Tornasol
TITULACIÓN
Introducción:
Para concluir con la última sección del blog, podemos apreciar el tema de la titulación, también llamado valoración, método por el cual se hace un análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida. Al final, podremos observar una serie de pantallazos tomados en Yenka, para un mejor aprendizaje.
Objetivos:
- Conocer el concepto de titulación.
- A través de los pantallazos interpretar con el marco teórico y aclarar el tema.
MARCO TEÓRICO
Titulación:
La valoración o titulación es un método de análisis químico cuantitativo en el laboratorio que se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida. Debido a que las medidas de volumen desempeñan un papel fundamental en las titulaciones, se le conoce también como análisis volumétrico.

Un reactivo llamado “valorante” o “titulador”,1 de volumen y concentración conocida (una solución estándar o solución patrón) se utiliza para que reaccione con una solución del analito,2 de concentración desconocida. Utilizando una bureta calibrada para añadir el valorante es posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final. El punto final es el punto en el que finaliza la valoración, y se determina mediante el uso de un indicador. Idealmente es el mismo volumen que en el punto de equivalencia—el número de moles de valorante añadido es igual al número de moles de analito, algún múltiplo del mismo (como en los ácidos polipróticos). En la valoración clásica ácido fuerte-base fuerte, el punto final de la valoración es el punto en el que el pH del reactante es exactamente 7, y a menudo la solución cambia en este momento de color de forma permanente debido a un indicador. Sin embargo, existen muchos tipos diferentes de valoraciones (ver más adelante). Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales (cambian de color). En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo en medio ácido y amarillo en disoluciones básicas. No todas las titulaciones requieren un indicador. En algunos casos, o bien los reactivos o los productos son fuertemente coloreados y pueden servir como "indicador". Por ejemplo, una titulación o valoración redox que utiliza permanganato de potasio como disolución estándar (rosa/violeta) no requiere indicador porque sufre un cambio de color fácil de detectar pues queda incolora al reducirse el permanganato. Después del punto de equivalencia, hay un exceso de la disolución titulante (permanganato) y persiste un color rosado débil que no desaparece.

Debido a la naturaleza logarítmica de la curva de pH, las transiciones en el punto final son muy rápidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de color del indicador y el punto de equivalencia de la titulación o valoración. Este error se denomina error del indicador. Por este motivo es aconsejable efectuar determinaciones en blanco con el indicador y restarle el resultado al volumen gastado en la valoración.
Pantallazos:
ÁCIDO CLORHÍDRICO