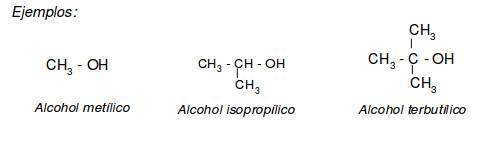Marco Teórico;
ALCOHOLES
Los alcoholes son compuestos con grupos hidroxilo unidos a un átomo de carbono saturados con hibridación sp3. Los fenoles son compuestos que tienen grupos hidroxilo unidos a anillos aromáticos.
Los alcoholes se encuentran ampliamente distribuidos en la naturaleza y tienen muchas aplicaciones industriales y farmacéuticas.
Los fenoles son abundantes en la naturaleza y también sirven como intermediarios en la síntesis industrial de productos como adhesivos y antisépticos. El fenol es un desinfectante general.
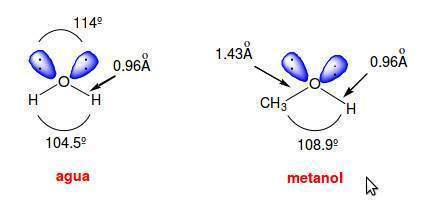
La estructura de un alcohol se asemeja a la del agua puesto que un alcohol procede de la sustitución formal de uno de los hidrógenos del agua por un grupo alquilo.
En el agua el ángulo del enlace H-O-H es de 104.5o y el ángulo que forman los dos pares de electrones no compartidos es de 114o. Estos ángulos de enlace se pueden explicar admitiendo una hibridación sp3 en el átomo de oxígeno.
No hay ninguna razón para que un átomo (oxígeno, nitrógeno, carbono, etc) forme un conjunto de orbitales híbridos equivalentes cuando no todos los orbitales se van a utilizar del mismo modo.
En el agua los orbitales híbridos sp3 que se van a emplear en los enlaces con los átomos de hidrógeno tienen un menor carácter s, lo que explica la disminución del ángulo de enlace tetraédrico desde 109.5o a 104.5o.
Por otra parte, los dos orbitales híbridos sp3, que contienen a los dos pares de electrones no enlazantes, tienen un mayor carácter s, lo que explica el aumento del ángulo de enlace desde 109.5o a 114o. El aumento del ángulo de enlace entre los pares de electrones no compartidos tiene un efecto estabilizante al disminuir la repulsión electrónica entre los mismos.
En el metanol el ángulo del enlace C-O-H es de 108.9o. Este ángulo es mayor que en el agua debido a la presencia del grupo metilo, mucho más voluminoso que el átomo de hidrógeno, que contrarresta el efecto de compresión del ángulo de enlace que provocan los dos pares de electrones no enlazantes.
Las longitudes de enlace O-H son aproximadamente las mismas en el agua que en los alcoholes, pero la distancia de enlace C-O es bastante mayor (1.4 Å) debido al mayor radio covalente del carbono en comparación con el del hidrógeno.
Clasificación:
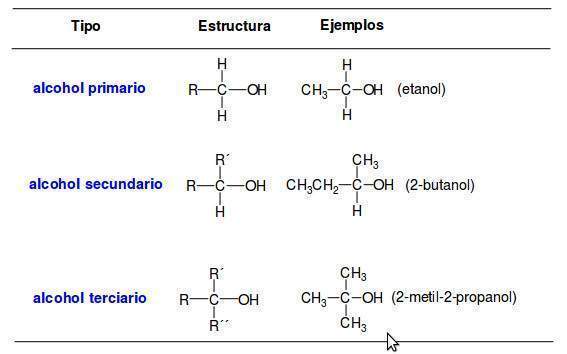
Una manera de organizar la familia de los alcoholes es clasificar a los alcoholes en primarios, secundarios o terciarios de acuerdo con el tipo de átomos de carbono enlazados al grupo OH. En la siguiente tabla se indican las estructuras de los alcoholes según su grado de sustitución:
Los alcoholes se clasifican en primarios (1°), secundarios (2°) o terciarios (3°), dependiendo del numero de sustituyentes unidos al carbono que tiene el hidroxilo.
Los alcoholes simples se designan como derivados del alcano progenitor y se utiliza el sufijo –ol.
Regla 1.- Seleccione la cadena de carbonos mas larga que contenga el grupo hidroxilo y derive el nombre del alcohol reemplazando la terminación –o del alcano correspondiente con –ol.
Regla 2.- Numere la cadena más larga de carbonos a partir del extremo más cercano al grupo hidroxilo.
Regla 3.- Numere los sustituyentes de acuerdo con su posición en la cadena y escriba el nombre, mencionando los sustituyentes en orden alfabético.
Nomenclatura:
En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol.
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
- Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -ol.
- La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay mas de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
- Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador.
Regla 1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

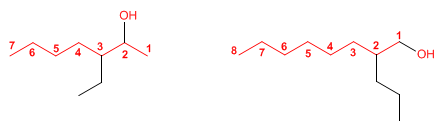


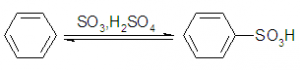

Regla 2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.

Propiedades:
En cuanto a sus propiedades, los alcoholes de baja masa molecular, están a temperatura ambiente en estado líquido y son incoloros, además de solubles en agua en mayor o menor medida.
A medida que aumenta el tamaño de la molécula también aumenta su punto de fusión y baja su solubilidad en el agua, llegando a poder estar en algunos casos en estado solido a temperatura ambiente. Aunque la mayoría de alcoholes tienen una densidad menor que la del agua, algunos, especialmente los que cuentan con anillos aromáticos, poseen una densidad mayor. La polaridad de los grupos -OH permite a estas moléculas establecer enlaces puente de hidrógeno con moléculas compañeras, o con aniones.
Aplicaciones:
El etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes). Es muy utilizado con fines culinarios (bebida alcohólica).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.

La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico y otros.
También se aprovechan sus propiedades desinfectantes. Se emplea como combustible industrial y doméstico.
En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la pirovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto.
Estudios del Departamento de Energía de USA dicen que el uso en automóviles reduce la producción de Gases de Efecto de Invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
FENOLES:
Los fenoles como dijimos, son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH. Son derivados aromáticos que presentan grupos "hidroxilo", -OH.
Los fenoles tienen cierto carácter ácido y forman sales metálicas.
Se encuentran ampliamente distribuidos en productos naturales, como los taninos.
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.

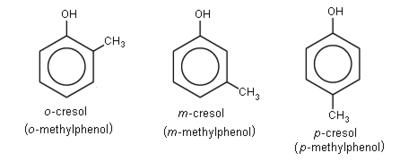
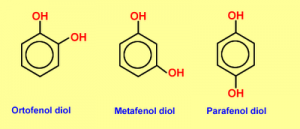
Si existen 2, 3 o más grupos OH se denominaran difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo estan vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si estan en lados opuestos para (p).

El fenol no existe en estado libre.
Se forma en la destilación seca de la hulla. Luego se destilan los aceites medios del alquitrán de hulla.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
A partir de la formación del ácido bencenosulfónico:
En la primera etapa el benceno reacciona con el ácido sulfúrico:
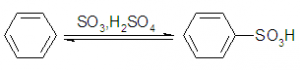
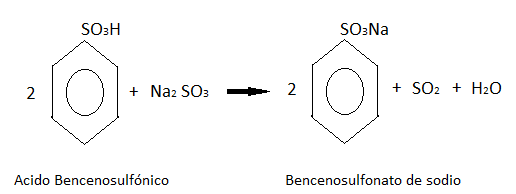
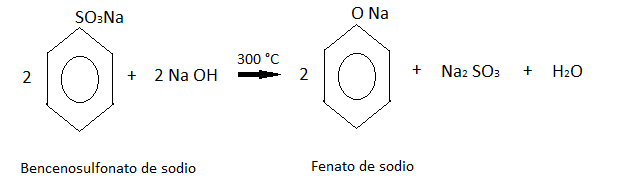
Este ácido formado después reacciona con el sulfito de sodio, dando como producto bencenosulfonato de sodio.

El bencenosulfonato de sodio después se concentra por evaporación y se combina con hidróxido de sodio.

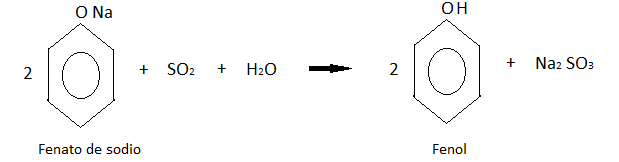
Este último producto se acidifica con dióxido de azufre de una de las reacciones anteriores, obteniendo finalmente al fenol.

Propiedades:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
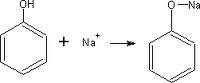
Formación de sales:
El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.

Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
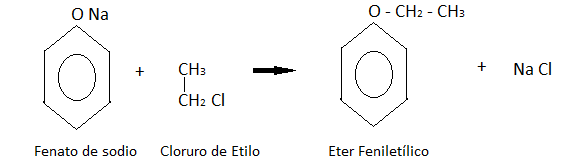
Formación de éteres:
Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.

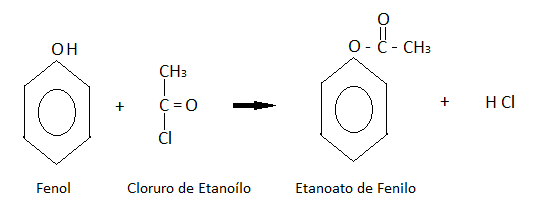
Formación de ésteres:
El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.

Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales.
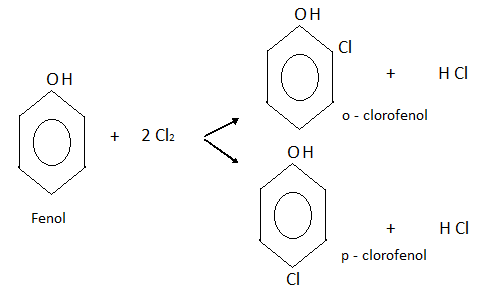
Halogenación:
Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.

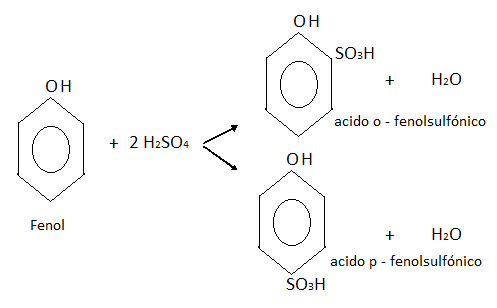
Sulfonación:
El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.

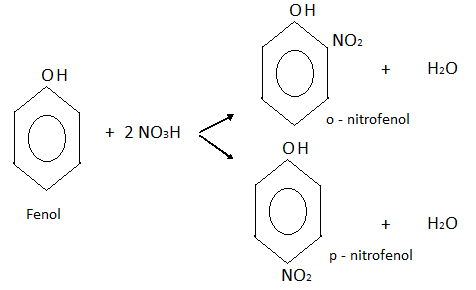
Nitración:
En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.

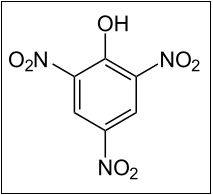
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.

Usos del Fenol: Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
Nomenclatura:
Para nombrar los fenoles se utiliza la terminación -ol precedida del nombre del hidrocarburo aromático correspondiente.
Si existen varios radicales -OH, se numeran los átomos de carbono del benceno de modo que los carbonos con grupos hidroxilo les corresponda la numeración más baja en conjunto, si hay varias posibilidades decidirá el orden de preferencia alfabético de los radicales.; al nombrar los polifenoles, deben escribirse los localizadores y los prefijos correspondientes: di, tri, etc. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
La IUPAC admite algunos nombres comunes:
 |  |  |  |
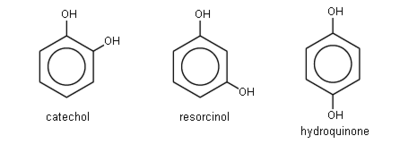
Pirocatecol (1,2-bencenodiol ó 1,2-dihidroxibenceno ó o-difenol
|
Resorcinol (1,3-bencenodiol ó 1,3-dihidroxibenceno ó m-difenol)
|
Hidroquinona (1,4-bencenodiol ó 1,4-dihidroxibenceno ó p-difenol)
|
3,4-xilol (3,4-dimetilfenol)
|
RADICALES
Los radicales de los fenoles Ar — O—, se nombran añadiendo la terminación -oxi al nombre del radical: (C6H5) — O —, fenoxi, etc
 |
2,3-dimetilfenol ó 2,3-xilol
|
 |
3-etil-1,2-bencenodiol ó 3-etil-1,2-difenol ó 3-etilpirocatecol
|
 |
2,3-dietilfenol
|
 |
2-ciclohexil-3-etil-4-metilfenol
|
 |
5-etil-3-isopropil-4-metil-2-vinilfenol
|
Ejercicios:
Alcoholes 1.
Alcoholes 2.
Fenoles 1.
Fenoles 2,
Webgrafía:
- http://www.100ciaquimica.net/fororg/ejer.htm
- http://paolapekemoxa.blogspot.com/2011/12/capitulo-17-alcoholes-y-fenoles.html
- https://medium.com/@salmaG/qu%C3%ADmica-org%C3%A1nica-nomenclatura-de-alcoholes-y-fenoles-bffaf421e43f
- http://agrega.juntadeandalucia.es/repositorio/31082016/f3/es-an_2016083113_9133751/5_alcoholes_y_fenoles.html
- http://www2.udec.cl/quimles/archivos/material-teorico/grupofun/alcohol/alcohol.htm