LEYES DE LOS GASES
Estados de agregación:
Los estados de
agregación, sólido, líquido y gaseoso,
dependen fundamentalmente de las condiciones de presión y temperatura a las que
esté sometida la materia.
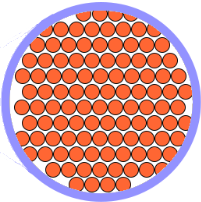 |
En el estado sólido los átomos o moléculas ocupan posiciones fijas aunque se encuentran vibrando en esas posiciones con una capacidad de movimiento limitada.
|
 |
En el estado líquido la fuerza de cohesión que mantiene unidas a las moléculas es mucho menor.
En un líquido las moléculas tienen una cierta capacidad de movimiento que, en gran medida, está limitada por las otras moléculas que tienen alrededor.
|
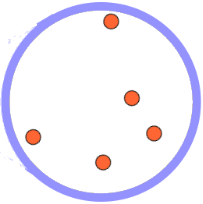 | En un gas las moléculas se encuentran muy lejanas unas de otras y se mueven en todas direcciones con libertad absoluta. |
Temperatura:
Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF). En este trabajo sólo utilizaremos las dos primeras.
¿Cómo se calibra un termómetro?
Mientras se está produciendo un cambio de estado la temperatura permanece constante y por ello consideramos los cambios de estado del agua (a 1 atm) como puntos de referencia.
Punto de fusión del agua:
La fase líquida se encuentra en equilibrio con la fase sólida y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
| |
Punto de ebullición del agua:
La fase líquida se encuentra en equilibrio con la fase gaseosa y la temperatura permanece constante.
Los valores otorgados a este punto en cada escala son:
|
En el intervalo de temperatura comprendido entre los puntos de fusión y ebullición, el agua permanece líquida. Este intervalo se divide en 100 partes en las escalas Celsius y Kelvin, mientras que en la escala Fahrenheit se divide en 180 partes.
| Presión = 1 atm | P.F. del agua | P.E. del agua | Divisiones |
| Escala Celsius | 0 | 100 | 100 |
| Escala Kelvin | 273.15 | 373.15 | 100 |
| Escala Fahrenheit | 32 | 212 | 180 |
| Relación entre las escalas |
| T(K) = T(°C) + 273.15 |
| T(°F) = T(°C)·1.8 + 32 |
Recuerda:
En los cálculos que vamos a realizar en este trabajo SIEMPRE habrá que expresar la temperatura en kelvin.
Presión:
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)

En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.